Uxmal Rodríguez
Elisa Carrillo
Enrique Soto
Instituto de Fisiología de la buap.
uxmalr@yahoo.com.mx
CANNABINOIDES: NEUROBIOLOGÍA Y USOS MÉDICOS
 [center]El receptor CB1 es muy abundante en el sistema nervioso central, pero no está distribuido de manera homogénea ya que se expresa principalmente en la corteza cerebral, hipocampo, núcleo caudado-putamen, substancia nigra pars reticulata, globo pálido y cerebelo. Además, se encuentra en bajos niveles en los centros respiratorios del tallo cerebral y también se expresa en las células gliales. Fuera del SNC el receptor CB1 se ha detectado en el bazo y, curiosamente, también en los testículos.10 Cabe destacar que los receptores CB1 son los más abundantes de todos los receptores acoplados a proteínas G en el cerebro, hecho que indica un papel funcional altamente relevante en una gran diversidad de circuitos y sistemas neuronales. 14
[center]El receptor CB1 es muy abundante en el sistema nervioso central, pero no está distribuido de manera homogénea ya que se expresa principalmente en la corteza cerebral, hipocampo, núcleo caudado-putamen, substancia nigra pars reticulata, globo pálido y cerebelo. Además, se encuentra en bajos niveles en los centros respiratorios del tallo cerebral y también se expresa en las células gliales. Fuera del SNC el receptor CB1 se ha detectado en el bazo y, curiosamente, también en los testículos.10 Cabe destacar que los receptores CB1 son los más abundantes de todos los receptores acoplados a proteínas G en el cerebro, hecho que indica un papel funcional altamente relevante en una gran diversidad de circuitos y sistemas neuronales. 14
El receptor CB2 se encuentra fundamentalmente en células del sistema inmunológico y, en menor grado, en nódulos linfáticos y en el bazo. 10 En el SNC se expresa principalmente en las células gliales y su expresión en neuronas es mínima, por lo que el papel funcional de los receptores tipo CB2 en el SNC parece limitado a la modulación de las respuestas inmunológicas.
La unión de los cannabinoides a sus receptores desencadena una cascada de segundos mensajeros. Inicialmente activan una proteína G que, a través de la subunidad a, modula la actividad de la adenilato ciclasa, la cual, a su vez, regula los niveles de adenosín monofosfato cíclico (AMPc) que modula la actividad de la proteína cinasa A (PKA).10 Finalmente, la activación de cinasas lleva a la fosforilación de diversas proteínas, incluyendo canales iónicos, proteínas de vesículas sinápticas, proteínas que regulan la transcripción genética y enzimas. Se ha demostrado que los cannabinoides inhiben canales de calcio dependientes de voltaje tipo N, P, Q y L, y que pueden también activar o inhibir corrientes de potasio. El efecto combinado sobre estos dos tipos de canales parece la base de la inhibición que los cannabinoides ejercen en la liberación de otros neurotransmisores. 15
Otros efectos que pueden producir los cannabinoides son el aumento de la producción de óxido nítrico (NO) y la activación de la proteína cinasa C (PKC); también hay reportes que indican la activación de la cinasa activada por mitógenos, la proteína cinasa B, fosfolipasas y el aumento de los niveles de calcio a expensas de los compartimentos intracelulares. 10
Por ejemplo, se ha demostrado que en el hipocampo la producción de endocannabinoides y su unión a receptores tipo CB1 funciona como un mecanismo de neurotransmisión retrógrada que media la inhibición de la liberación de ácido gamma amino butírico (GABA, principal neurotransmisor inhibitorio en el SNC). De hecho, se ha establecido la posibilidad de que dicha función como neurotransmisor retrógrado tenga un papel importante en el desarrollo de la potenciación de larga duración que, a nivel celular, constituye un elemento fundamental en los procesos de aprendizaje. 9
En suma, tenemos compuestos de origen vegetal como el D9-thc, D8-thc y cannabidiol, y compuestos de origen endógeno en organismos animales, como la anandamida y el 2-araquidonil-glicerol, todos ellos con acción sobre los receptores a cannabinoides. A ellos se agrega una serie importante de compuestos de origen sintético como el Win 55212-2 (derivado de aminoalquilindoles) y el SR141716A (rimonabant) entre muchos otros, todos, naturales y sintéticos, con potenciales usos médicos y que constituyen una fuente importante de investigación en busca de nuevos fármacos. 16
Elisa Carrillo
Enrique Soto
Instituto de Fisiología de la buap.
uxmalr@yahoo.com.mx
CANNABINOIDES: NEUROBIOLOGÍA Y USOS MÉDICOS
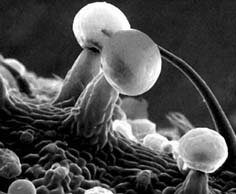
La planta de mariguana, Cannabis sativa, ha sido utilizada por el hombre desde la antigüedad con varios fines: obtención de fibras textiles, propósitos curativos, recreativos, en la gastronomía, en lienzos para pintura al óleo (la palabra canvas, es decir, lienzo, deriva de cannabis, oil on canvas) entre otros. 1 Su cultivo es relativamente simple y constituye la planta con más alto potencial para la generación de biomasa en el planeta, por lo que su uso industrial es muy importante, aunque lamentablemente es desaprovechado ya que su cultivo está prohibido en prácticamente todos los países. Sus efectos biológicos se deben a un conjunto de compuestos presentes en la resina secretada por las hojas y brotes florecidos de la planta (Figura 1), la que produce cerca de cuatrocientos compuestos químicos, de los cuales unos sesenta se consideran dentro del grupo de los cannabinoides. 2 No se conoce bien la función de los cannabinoides en las plantas, aunque se ha propuesto que tienen un efecto protector contra los insectos. En animales, las principales acciones de los cannabinoides son sobre los sistemas cardiovascular, inmunológico y nervioso central (SNC). En el sistema cardiovascular producen disminución de la presión arterial debido a la vasodilatación, aumento subsecuente de la frecuencia cardiaca e hipotensión ortostática. En altas dosis, muy por arriba de las que se usan para consumo recreativo, producen una depresión significativa del sistema inmunológico. A nivel del SNC sus acciones se caracterizan principalmente por una importante reducción de la movilidad, disminución de la temperatura y analgesia, además de sus bien conocidos efectos de tipo cognitivo. 1

FIGURA 1. Microscopía electrónica de barrido de una glándula pedunculada de una hoja de la planta Cannabis sativa.
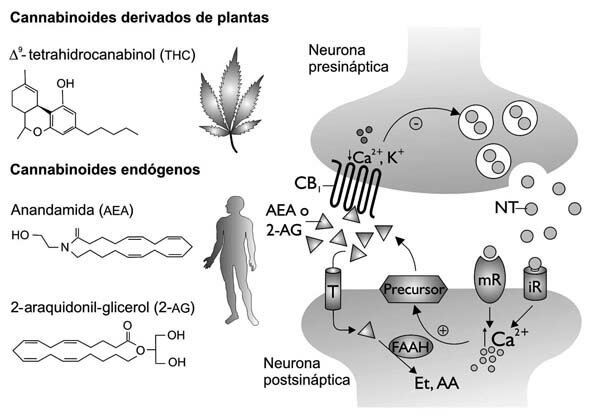
Los cannabinoides son substancias que tienen una estructura carboxílica con veintiún carbonos y están formados por tres anillos, ciclohexano, tetrahidropirano y benceno (Figura 2). Los principales cannabinoides son el D9-tetrahidrocannabinol (D9-THC), el D8-tetrahidrocannabinol (D8-THC), el cannabidiol (CBD) y el cannabinol (CBN). Otros cannabinoides presentes en la planta aparecen en cantidades diferentes según la variedad de Cannabis . El ácido cannabidiólico, que tiene actividad antibiótica, es un constituyente del cáñamo. 3

FIGURA 2. A la izquierda, la estructura del principal cannabinoide psicoactivo, el D9-tetrahidrocannabinol y la estructura de los principales cannabinoides endógenos: la anandamida (araquidonil-etanolamida) y el 2-araquidonil-glicerol. A la derecha, principales acciones de los cannabinoides a nivel neuronal. Los cannabinoides se sintetizan a partir de lípidos de membrana, se producen bajo demanda y no se almacenan en vesículas como ocurre con otros neurotransmisores. Los endocannabinoides se producen como consecuencia de aumentos en el Ca2+ intracelular e interactúan con receptores CB1 ubicados en las neuronas presinápticas, modulando la liberación del neurotransmisor (NT). Éste activa a receptores ionotrópicos (iR) y/o metabotrópicos (mR). Los endocannabinoides son removidos del espacio sináptico por un transportador específico (T); ya en el citoplasma, son degradados por la hidrolasa de la amida de ácidos grasos (FAAH) a etanolamina (Et) y ácido araquidónico (AA). (Modificado de Guzmán, 2003.)
En 1964 el grupo de Mechoulam, en Israel, encontró que el principal compuesto psicoactivo de la mariguana ?y el de mayor potencia? es el D9-THC. Éste presenta propiedades hidrofóbicas, por lo que es muy soluble en lípidos. Esto hace que su distribución en el organismo y su eliminación presenten diferencias con respecto a lo descrito para otras drogas de abuso. El D8-THC tiene un perfil farmacológico muy parecido al del D9-THC, aunque sus efectos son más débiles; sólo aparece en algunas variedades de la planta y su concentración es pequeña en comparación con la del D9-THC. 4
De manera análoga a lo sucedido con los opioides, en particular la morfina y sus derivados, donde su estudio llevó a proponer la existencia de receptores específicos para estas substancias en el SNC ?hecho que finalmente permitió identificar las encefalinas y endorfinas como ligandos endógenos de dichos receptores?, 5 ocurrió que el estudio de los mecanismos de acción de los cannabinoides, en particular del D9-THC, llevó a pensar que en el cerebro realmente existían receptores para cannabinoides. Finalmente se demostró que éstos ejercen su efecto a través de receptores específicos de membrana y, en 1990, se clonó e identificó el primer receptor a cannabinoides en tejido nervioso, el cual se conoce como CB1 (cannabinoid binding 1). 6 En 1993 se clonó, en células del sistema inmunológico, otro receptor a cannabinoides, el receptor CB2. 7
En consonancia con la idea de que existían receptores a cannabinoides, en 1992 Devane y colaboradores reportaron a la etanolamida del ácido araquidónico como el primero de los endocannabinoides, los cuales son ligandos endógenos de los receptores a cannabinoides (Figura 2). 8 A esta substancia, los investigadores que la descubrieron la denominaron ?anandamida?, que deriva de una palabra en sánscrito, ananda, que quiere decir ?el bienestar interior?, ?la gloria?, ?la bienaventuranza?. Posteriormente se encontraron otros ligandos endógenos de los receptores a cannabinoides, como el 2-araquidonil-glicerol, la palmitoiletanolamida y otros lípidos relacionados. Los endocannabinoides se producen principalmente en el hipocampo, el tálamo, el cuerpo estriado, la corteza cerebral, el puente, el cerebelo y la médula espinal.
Cabe destacar que lípidos del tipo de los cannabinoides endógenos no son exclusivos del cerebro de los vertebrados superiores, y algunas plantas producen estas substancias. De hecho, se discute si parte de los procesos que determinan el apetito peculiar que algunas personas tienen por el chocolate es debido a que el cacao contiene pequeñas concentraciones de anandamida y 2-araquidonil-glicina, por cierto, también presentes en muy bajas concentraciones en la leche materna.
Los cannabinoides endógenos se sintetizan a partir de la N-araquidonil-fosfatidil-etanolamina en la membrana celular, y son degradados aparentemente por hidrolasas de ácidos grasos (Figura 2). La síntesis de los cannabinoides es modulada por las concentraciones intracelulares de Ca2+ aunque, a diferencia de otros neurotransmisores, los endocannabinoides no se almacenan en vesículas sinápticas, sino que se liberan directamente de la membrana celular. Se discute además, aunque no se ha corroborado de forma definitiva la existencia de un mecanismo de transporte específico que pudiera permitir a las neuronas transportar los endocannabinoides. 9
En conjunto, estos resultados han llevado a postular que en el cerebro de los mamíferos superiores existe un sistema endocannabinérgico que participa en la transmisión de información en el sistema nervioso central. Se han descrito receptores específicos, ligandos endógenos, los mecanismos de síntesis de dichos ligandos, así como de la eliminación y recaptura de éstos a nivel sináptico.
RECEPTORES A CANNABINOIDES
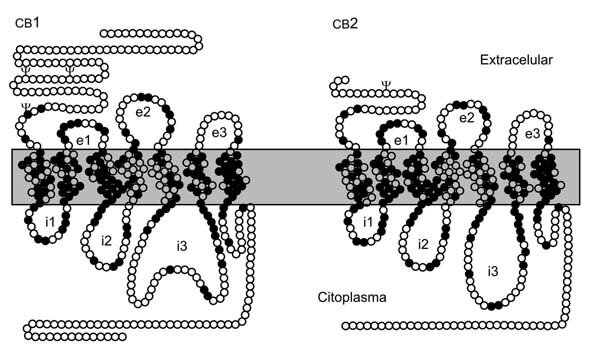
Hasta el momento se han identificado dos tipos de receptores para cannabinoides: los receptores CB1 y CB2, ambos pertenecientes a la superfamilia de receptores acoplados a proteínas G, caracterizados por tener siete dominios transmembrana (Figura 3). El receptor CB1 se localiza fundamentalmente en el sistema nervioso central; el receptor CB2, en el bazo, amígdalas y células del sistema inmunológico. Entre ambos receptores, CB1 y CB2, hay una homología de alrededor del 48%. 10 Existen evidencias que sugieren la existencia de un subtipo de receptor a cannabinoides que, se ha propuesto, es una variante por empalmes alternativos (alternative splicing) del receptor CB1. En el humano y en la rata, este receptor tiene 61 aminoácidos menos en el extremo amino terminal que el CB1, y de acuerdo con ello se nombraría CB1b. 11 En ratones en los que por medio de biología molecular se elimina la expresión de los genes que codifican para el receptor CB1 (ratones knock-out CB1 -/-), se ha estudiado el efecto que tienen los agonistas y antagonistas de estos receptores midiendo la activación de proteínas G. La anandamida y el agonista a cannabinoides Win 55212-2 demostraron tener actividad en estos ratones. 12 Estos resultados refuerzan la idea de la existencia de un subtipo de receptor CB1. Sin embargo, hay también evidencias que sugieren la expresión de receptores a cannabinoides distintos de CB1/CB1b y CB2 en las células gliales de la corteza cerebral en la rata. 13
De manera análoga a lo sucedido con los opioides, en particular la morfina y sus derivados, donde su estudio llevó a proponer la existencia de receptores específicos para estas substancias en el SNC ?hecho que finalmente permitió identificar las encefalinas y endorfinas como ligandos endógenos de dichos receptores?, 5 ocurrió que el estudio de los mecanismos de acción de los cannabinoides, en particular del D9-THC, llevó a pensar que en el cerebro realmente existían receptores para cannabinoides. Finalmente se demostró que éstos ejercen su efecto a través de receptores específicos de membrana y, en 1990, se clonó e identificó el primer receptor a cannabinoides en tejido nervioso, el cual se conoce como CB1 (cannabinoid binding 1). 6 En 1993 se clonó, en células del sistema inmunológico, otro receptor a cannabinoides, el receptor CB2. 7
En consonancia con la idea de que existían receptores a cannabinoides, en 1992 Devane y colaboradores reportaron a la etanolamida del ácido araquidónico como el primero de los endocannabinoides, los cuales son ligandos endógenos de los receptores a cannabinoides (Figura 2). 8 A esta substancia, los investigadores que la descubrieron la denominaron ?anandamida?, que deriva de una palabra en sánscrito, ananda, que quiere decir ?el bienestar interior?, ?la gloria?, ?la bienaventuranza?. Posteriormente se encontraron otros ligandos endógenos de los receptores a cannabinoides, como el 2-araquidonil-glicerol, la palmitoiletanolamida y otros lípidos relacionados. Los endocannabinoides se producen principalmente en el hipocampo, el tálamo, el cuerpo estriado, la corteza cerebral, el puente, el cerebelo y la médula espinal.
Cabe destacar que lípidos del tipo de los cannabinoides endógenos no son exclusivos del cerebro de los vertebrados superiores, y algunas plantas producen estas substancias. De hecho, se discute si parte de los procesos que determinan el apetito peculiar que algunas personas tienen por el chocolate es debido a que el cacao contiene pequeñas concentraciones de anandamida y 2-araquidonil-glicina, por cierto, también presentes en muy bajas concentraciones en la leche materna.
Los cannabinoides endógenos se sintetizan a partir de la N-araquidonil-fosfatidil-etanolamina en la membrana celular, y son degradados aparentemente por hidrolasas de ácidos grasos (Figura 2). La síntesis de los cannabinoides es modulada por las concentraciones intracelulares de Ca2+ aunque, a diferencia de otros neurotransmisores, los endocannabinoides no se almacenan en vesículas sinápticas, sino que se liberan directamente de la membrana celular. Se discute además, aunque no se ha corroborado de forma definitiva la existencia de un mecanismo de transporte específico que pudiera permitir a las neuronas transportar los endocannabinoides. 9
En conjunto, estos resultados han llevado a postular que en el cerebro de los mamíferos superiores existe un sistema endocannabinérgico que participa en la transmisión de información en el sistema nervioso central. Se han descrito receptores específicos, ligandos endógenos, los mecanismos de síntesis de dichos ligandos, así como de la eliminación y recaptura de éstos a nivel sináptico.
RECEPTORES A CANNABINOIDES
Hasta el momento se han identificado dos tipos de receptores para cannabinoides: los receptores CB1 y CB2, ambos pertenecientes a la superfamilia de receptores acoplados a proteínas G, caracterizados por tener siete dominios transmembrana (Figura 3). El receptor CB1 se localiza fundamentalmente en el sistema nervioso central; el receptor CB2, en el bazo, amígdalas y células del sistema inmunológico. Entre ambos receptores, CB1 y CB2, hay una homología de alrededor del 48%. 10 Existen evidencias que sugieren la existencia de un subtipo de receptor a cannabinoides que, se ha propuesto, es una variante por empalmes alternativos (alternative splicing) del receptor CB1. En el humano y en la rata, este receptor tiene 61 aminoácidos menos en el extremo amino terminal que el CB1, y de acuerdo con ello se nombraría CB1b. 11 En ratones en los que por medio de biología molecular se elimina la expresión de los genes que codifican para el receptor CB1 (ratones knock-out CB1 -/-), se ha estudiado el efecto que tienen los agonistas y antagonistas de estos receptores midiendo la activación de proteínas G. La anandamida y el agonista a cannabinoides Win 55212-2 demostraron tener actividad en estos ratones. 12 Estos resultados refuerzan la idea de la existencia de un subtipo de receptor CB1. Sin embargo, hay también evidencias que sugieren la expresión de receptores a cannabinoides distintos de CB1/CB1b y CB2 en las células gliales de la corteza cerebral en la rata. 13

FIGURA 3. Representación esquemática de los receptores CB1 y CB2. Los receptores tienen siete segmentos transmembrana. (Círculos negros) Aminoácidos comunes a los dos receptores; (círculos vacíos) aminoácidos diferentes; ([simbolo tridente]) sitios consenso de glicosilación. (e1, e2, e3) son asas extracelulares; (i1, i2, i3) son asas intracelulares.
El receptor CB2 se encuentra fundamentalmente en células del sistema inmunológico y, en menor grado, en nódulos linfáticos y en el bazo. 10 En el SNC se expresa principalmente en las células gliales y su expresión en neuronas es mínima, por lo que el papel funcional de los receptores tipo CB2 en el SNC parece limitado a la modulación de las respuestas inmunológicas.
La unión de los cannabinoides a sus receptores desencadena una cascada de segundos mensajeros. Inicialmente activan una proteína G que, a través de la subunidad a, modula la actividad de la adenilato ciclasa, la cual, a su vez, regula los niveles de adenosín monofosfato cíclico (AMPc) que modula la actividad de la proteína cinasa A (PKA).10 Finalmente, la activación de cinasas lleva a la fosforilación de diversas proteínas, incluyendo canales iónicos, proteínas de vesículas sinápticas, proteínas que regulan la transcripción genética y enzimas. Se ha demostrado que los cannabinoides inhiben canales de calcio dependientes de voltaje tipo N, P, Q y L, y que pueden también activar o inhibir corrientes de potasio. El efecto combinado sobre estos dos tipos de canales parece la base de la inhibición que los cannabinoides ejercen en la liberación de otros neurotransmisores. 15
Otros efectos que pueden producir los cannabinoides son el aumento de la producción de óxido nítrico (NO) y la activación de la proteína cinasa C (PKC); también hay reportes que indican la activación de la cinasa activada por mitógenos, la proteína cinasa B, fosfolipasas y el aumento de los niveles de calcio a expensas de los compartimentos intracelulares. 10
Por ejemplo, se ha demostrado que en el hipocampo la producción de endocannabinoides y su unión a receptores tipo CB1 funciona como un mecanismo de neurotransmisión retrógrada que media la inhibición de la liberación de ácido gamma amino butírico (GABA, principal neurotransmisor inhibitorio en el SNC). De hecho, se ha establecido la posibilidad de que dicha función como neurotransmisor retrógrado tenga un papel importante en el desarrollo de la potenciación de larga duración que, a nivel celular, constituye un elemento fundamental en los procesos de aprendizaje. 9
En suma, tenemos compuestos de origen vegetal como el D9-thc, D8-thc y cannabidiol, y compuestos de origen endógeno en organismos animales, como la anandamida y el 2-araquidonil-glicerol, todos ellos con acción sobre los receptores a cannabinoides. A ellos se agrega una serie importante de compuestos de origen sintético como el Win 55212-2 (derivado de aminoalquilindoles) y el SR141716A (rimonabant) entre muchos otros, todos, naturales y sintéticos, con potenciales usos médicos y que constituyen una fuente importante de investigación en busca de nuevos fármacos. 16


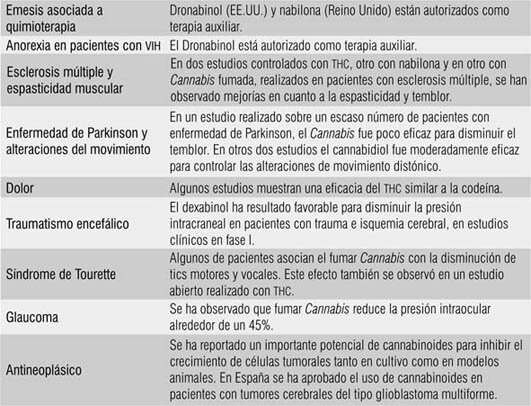
 3179-3188.
3179-3188.

Comentario